Günlük Hayatta Kullanılan Bileşik ÖrnekleriBileşik, atomları birbirine bağlı iki veya daha fazla kimyasal element içeren maddedir. Bu atomlar, belirli şekillerde ve oranlarda kimyasal olarak bağlanır ve fiziksel yöntemlerle ayrılmazlar.
İyonlar, moleküller, asitler, katyonlar ve anyonlar da dahil olmak üzere birçok farklı bileşik tipi vardır. Bu tür bileşiklerin farklı özellikleri ve farklı kimyasal yapıları vardır.
Bileşiklere Örnekler: 1. Su – Formül:
1. Su – Formül: 
= 2 Hidrojen + Oksijen
İki hidrojen atomu, bir oksijen atomuyla kovalent bağ ile bağlanarak suyu oluşturur. Hidrojenin pozitif bir yükle yüklüdür ve oksijen negatif bir yüke sahiptir. Bu nedenle su molekülü polar yani kutupsal bir moleküldür. Su, elektroliz yoluyla hidrojen ve oksijene ayrılabilir.
2. Hidrojen Peroksit – Formül:

= 2 Hidrojen + 2 Oksijen
Hidrojen peroksit, iki hidrojen atomu ile iki oksijen atomunun oluşturduğu bileşiktir. Bir su molekülünde (

) mevcut olana kıyasla sadece bir oksijen atomu daha olmasına rağmen, özellikleri çok farklıdır.
3. Tuz – Formül: NaCl = Sodyum + Klor
Tuz oluşumunda, bir sodyum ile bir klor atomu biraraya gelerek iyonik bileşik oluştururlar. Tuz, deniz suyunu buharlaştırılması yada tuz madenlerinden çıkarılarak ticari anlamda kolayca üretilebilir. Sodyum klorür elektroliz yoluyla atomlarına (sodyum ve klor) ayrılabilir.
4. Kabartma Tozu – Karbonat – Formül:
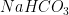
= Sodyum + Hidrojen + Karbon + 3 Oksijen
Sodyum bikarbonat ise yeterince yüksek yoğunlukta karbondioksit ve su tepkimesi ile elde edilebilir. Kaplıcalarda doğal olarak bulunur, ancak endüstriyel kullanımlar için ticari amaçlı üretilir.
5. Oktan – Formül:

= 8 Karbon + 18 Hidrojen
Oktan, asıl formülü
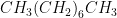
olan bir hidrokarbondur. Düşük molekül ağırlıklı bir bileşiktir, bu da oldukça uçucu ve yanıcı olmasına neden olur. Benzin üretiminde kullanılması uygundur.
Alinti


